环丙烷是活性天然产物和药物中常见的结构片段,也是重要的合成砌块,以及一些手性配体的核心骨架。环丙烷硼酸酯类化合物在近年来受到广泛关注,其中的硼酸酯官能团可以用于多种后期衍生化反应。因此,发展高效合成手性环丙烷硼酸酯的方法具有重要的研究价值。华东师范大学化学与分子工程学院洪恺课题组发展了一种不依赖过渡金属催化剂的方法,在温和条件下,利用γ-位离去基团促进偕二硼酸酯的活化,通过立体专一性的分子内关环反应,实现了环丙烷硼酸酯的立体选择性合成。相关成果发表在化学领域顶级期刊《德国应用化学》(Angew. Chem. Int. Ed.)上(Angew. Chem. Int. Ed., 2023, 62, e202302638)。
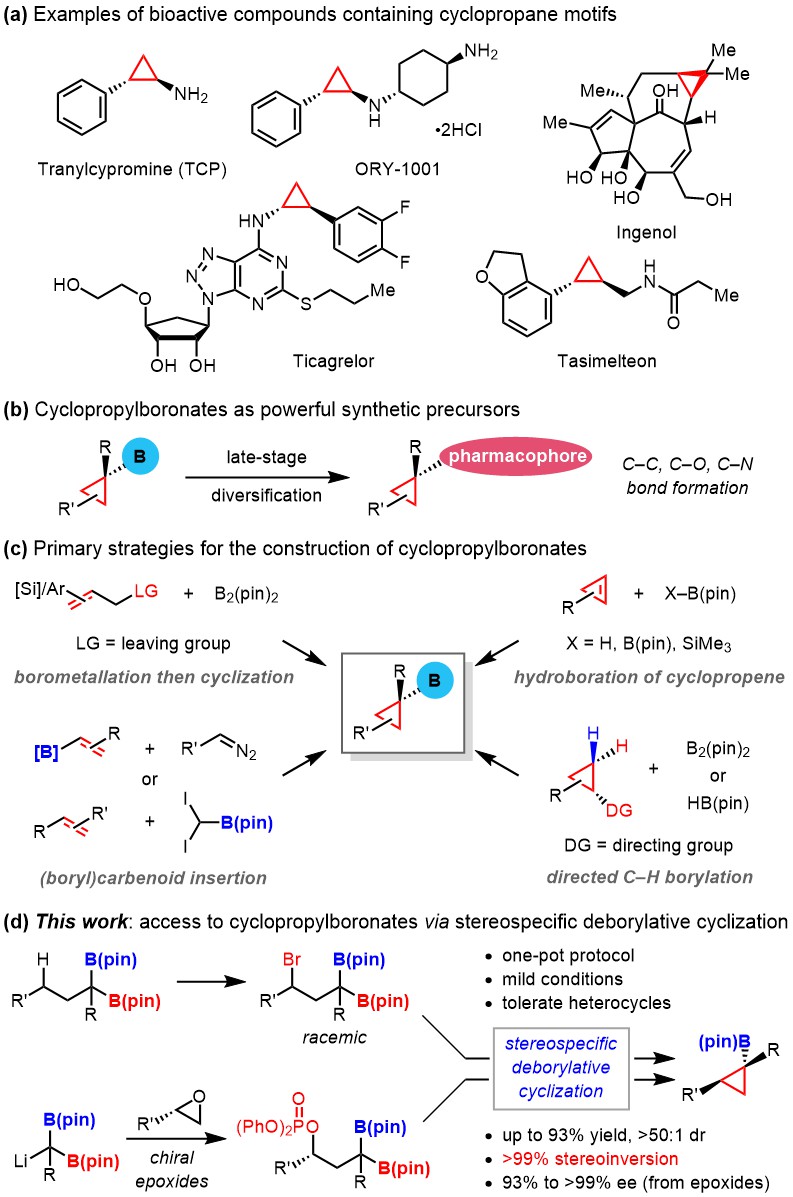
图1. 环丙烷硼酸酯的研究意义
课题组发展了两条合成路线,分别用于消旋和光学活性产物的制备。该策略具有诸多优点,例如:原料廉价易得、产物非对映选择性高(dr > 50:1)、对映异构体过量值高(93% – >99% ee)以及对映异构体特异性高(es > 99%,es = 产物的ee值/原料的ee值)。

图2. 利用立体专一性的分子内关环反应实现环丙烷硼酸酯合成的新策略
在本项研究工作中,作者首先通过光照条件下的自由基溴代反应在底物中引入溴离去基团,随后对该底物在碱的作用下进行的关环反应进行了研究。在LiOH·H2O作用下能够以优异的产率(up to 93% yield)和非对映选择性的结果(>50:1 dr)得到预期产物。进一步研究发现,当溴代试剂为NBP (N-溴酞亚胺)时,可以通过两步一锅法合成一系列消旋的环丙烷硼酸酯化合物。该反应体现了非常好的官能团耐受性,例如R’可以是氢、多种取代的芳基,也可以是吡啶、呋喃等杂环。随后,课题组对光学活性的环丙基硼酸酯的合成进行了研究。选用手性环氧为原料与锂化双硼反应,并使用氯磷酸二苯酯进行保护,得到了手性的起始原料。该原料同样可以在弱碱的作用下进行关环,得到非对映选择性的产物。在这条路线中,该转化具有优异的对映异构体特异性(es > 99%)。与原料环氧相比,产物的ee值始终不变。克级反应也能以较高的收率和立体选择性得到目标产物。为了进一步证明得到的环丙基硼酸酯的实用性,作者对产物进行了多种衍生,并成功应用在LSD1/KDM1A抑制剂ORY-1001的高效合成中。
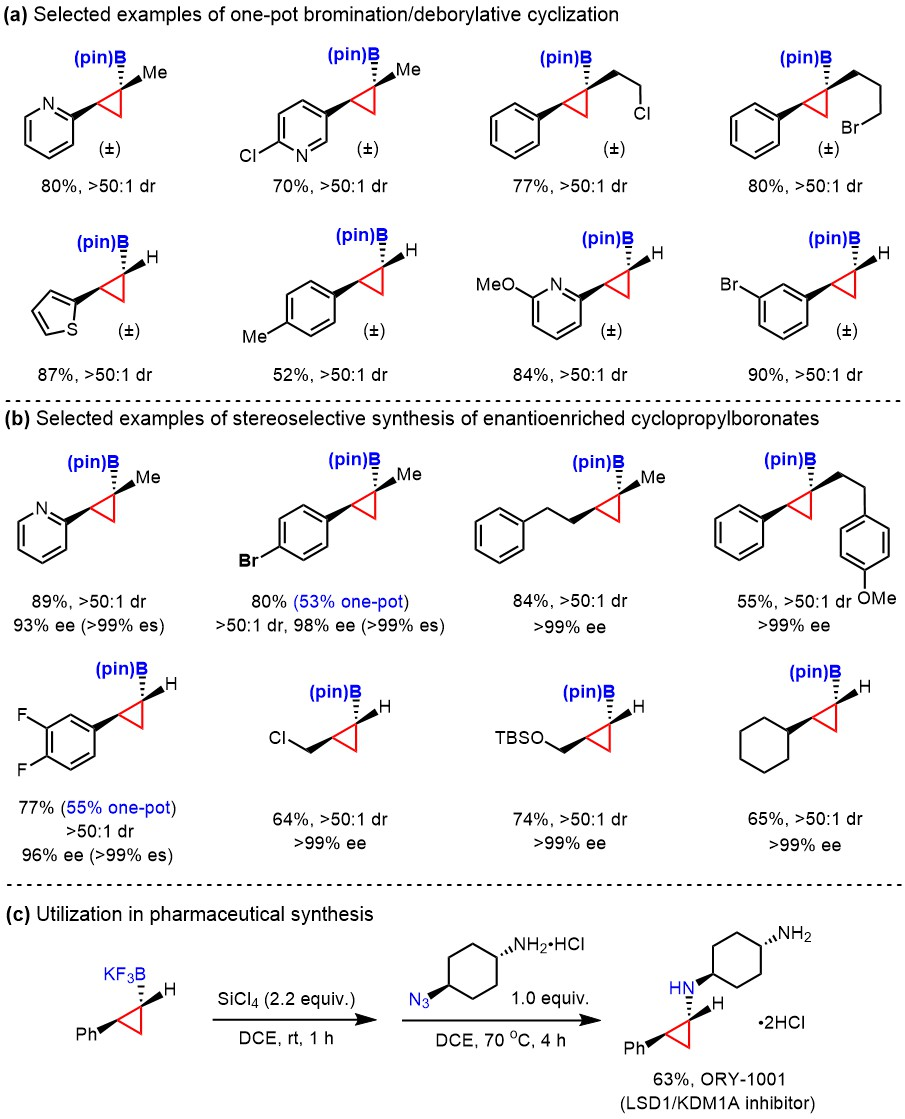
图3. 底物范围与合成应用
在机理研究中,课题组发现底物的手性中心在关环过程中发生了立体翻转。排除碳负离子中间体的途径后,作者认为这一现象可以通过协同的1,3-消除反应机理来解释。这也是首例利用γ-位离去基团来促进偕二硼酸酯活化的报道。
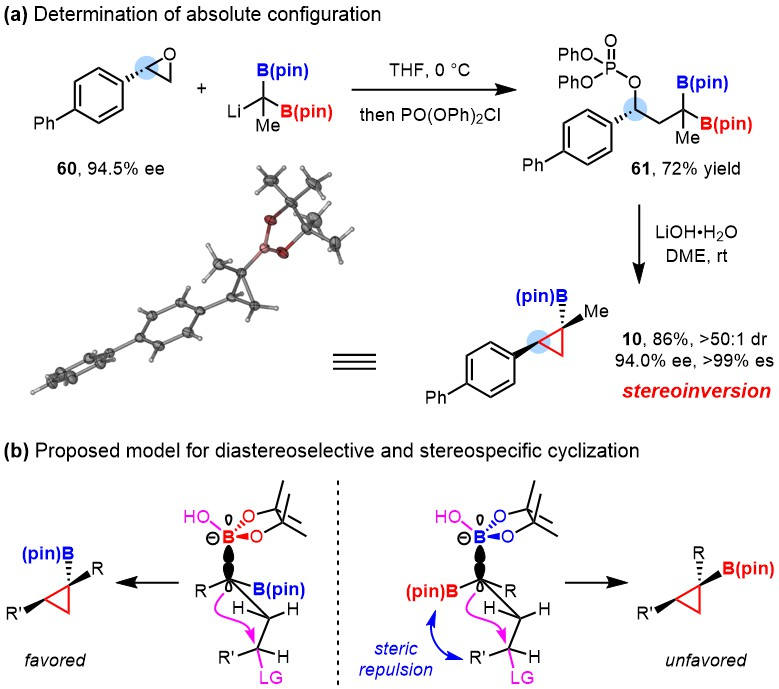
图4. 反应机理研究
洪恺研究员课题组主要从事有机合成方法学的研究工作,聚焦不对称催化和有机硼化学。文章的共同第一作者是华东师范大学化学与分子工程学院的博士研究生陈新义和硕士研究生高风晨,洪恺研究员为论文通讯作者。
文章链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202302638
